國立高雄科技大學
漁業科技與管理系
莊明芬
國立高雄科技大學
漁業科技與管理系副教授
鄭有容
珊瑚寄生橈足類多樣性
說到海洋生物,多數人都會聯想到鯊魚、海豚等大型動物,然而,海洋裡還有一群肉眼無法輕易看到的小型生物,提供海洋生物所需的養分,支持著海洋生態的豐富度,牠們就是「橈足類」。不過橈足類除了是許多海洋生物的美食外,也有許多橈足類是海洋無脊椎動物的寄生蟲,目前學界已知有1,500種橈足類寄生於無脊椎動物中,其中大約552種(佔總數的37%)以刺細胞動物為宿主。在刺細胞動物之中,珊瑚綱(Anthozoa)比其他刺細胞動物更容易受到橈足類的寄生,已知227種橈足類以六放珊瑚為宿主,161種屬於八放珊瑚的寄生蟲〔1〕。然而,有學者指出,石珊瑚243屬1,579 種現存物種之中,只有66屬148種(9.4%)曾有發現橈足類的紀錄,顯示我們對於珊瑚寄生橈足類多樣性的瞭解仍明顯不足〔2〕。
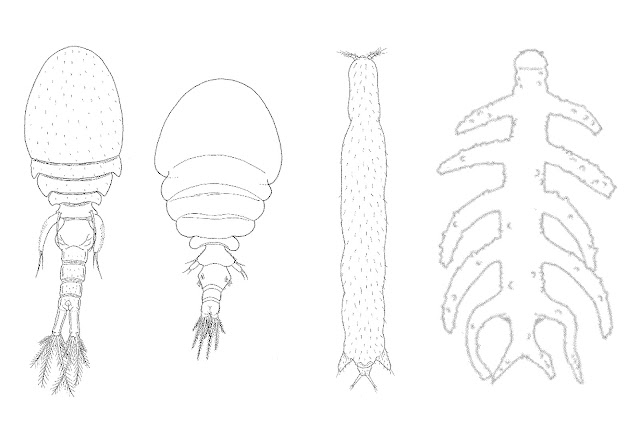
橈足類是海洋生態系統中最多樣化和最豐富的動物群之一,也是與其他生物共生關係中最常見、分佈最廣的甲殼類動物。根據傳統的形態特徵,可以將橈足類區分成10個目(Order),分別是哲水蚤目(Calanoida)、劍水蚤目(Cyclopoida)、隱水蚤目(Gelyelloida)、猛水蚤目(Harpacticoida)、異水蚤目(Misophrioida)、怪水蚤目(Monstrilloida)、摩門虱目(Mormonilloida)、平角水蚤目(Platycopioida)、杯口水蚤目(Poecilostomatoida)和吸管口目(Siphonostomatoida),共計約1萬5千餘種〔3〕。寄生橈足類分為寄生於宿主體內的「內寄生」與體外的「外寄生」。在上述橈足類各種目別之中,劍水蚤目(根據分子證據目前已與杯口水蚤目合併)是在石珊瑚中最常見的寄生橈足類,具有最多的物種數量,也是主要的內寄生性寄生蟲(endo-parasite)(圖一),其次分別為吸管口目和猛水蚤目的種類,牠們的種類多樣性相對較低,且主要是外寄生性的寄生蟲(ecto-parasite)(圖一),牠們數量變化與環境因子較有關係,與石珊瑚宿主的關係較為鬆散〔1〕〔2〕。迄今,共計有363種橈足類被記錄為石珊瑚的寄生蟲,其中包括288種劍水蚤、68種吸管口目和7種猛水蚤〔2〕。
珊瑚寄生橈足類多樣性熱點(hot spot)及種類組成差異
就和人類一樣,珊瑚寄生橈足類對於居住地點也有自己的喜好。科學家發現在印度洋、太平洋和大西洋等海域發現的橈足類在數量與物種間都具有明顯差異,超過90%的珊瑚寄生橈足類物種皆分佈在印度—西太平洋水域,意即印度洋及太平洋是珊瑚寄生橈足類物種多樣性的熱點(hot spot),然而,大西洋卻只發現了少數物種(<10%)〔1〕〔4〕。就珊瑚寄生橈足類物種組成而言,印度—西太平洋與大西洋也具有明顯不同,印度—西太平洋珊瑚寄生橈足類主要為外寄生性的Lichomolgidae與內寄生性的珊虱科(Xarifiidae);大西洋則以外寄生性的星管水蚤科(Asterocheridae),和內寄生性且體型高度變態的Corallovexiidae為主(見前述圖一)。造成大洋間珊瑚寄生橈足類組成差異的主要原因尚不清楚,科學家推測可能與海平面波動、低水溫/冰河期和地質事件等地理隔離影響,造成珊瑚宿主多樣性和物種豐富度極劇減少有關〔4〕。的確,若以Lichomolgidae和珊虱科為例,牠們是印度—西太平洋珊瑚上常見的外寄生及內寄生橈足類,但在太平洋東部和加勒比海卻從未有過發現的紀錄。然而,加勒比海雖然珊瑚種類低,但仍具有例如軸孔珊瑚(Acropora spp.)、菊珊瑚(Favia spp.)、孔珊瑚(Porites spp.)和管星珊瑚(Tubastrea spp.)等印度—西太平洋常見的珊瑚,這可能是因為上新世之前,巴拿馬地峽仍然開放時,寄生橈足類並未向東傳播到加勒比海和太平洋東部之緣故〔5〕。
寄生橈足類的「嬰兒房」─蟲癭形成
喜愛自然的讀者在野外可能會看到葉片上長了一顆顆的「果子」,這並非什麼新奇植物,而是「蟲癭」(gall)現象,指的是植物受到昆蟲等生物刺激而不正常增生,是這些昆蟲為牠們的寶寶打造的「嬰兒房」。而珊瑚寄生橈足類也會誘使珊瑚形成蟲癭結構。棲息於珊瑚表面的外寄生性橈足類,會利用附肢上的剛毛刺激珊瑚的軟組織,造成珊瑚骨骼的過度增生,形成蟲癭並棲息於其中,被稱為gallicolous或gall-forming copepod。
目前僅有五種寄生橈足類具有誘導石珊瑚產生蟲癭的能力,牠們寄生於軸孔珊瑚科(Acroporidae)、繩紋珊瑚科(Merulinidae)、鹿角珊瑚科(Pocilloporidae)和微孔珊瑚科(Poritidae)的珊瑚中。
一位名為Dojiri的科學家是第一個發現寄生橈足類會造成石珊瑚形成蟲癭的學者,他從印度尼西亞海域的尖枝列孔珊瑚(Seriatopora hystrix)上發現許多骨骼增生的小隆起,這些小隆起外形像小火山,頂部僅具有一小開口,檢視骨骼內部後,從內發現Isomolgus desmotes的雌蟲,雌蟲的體型約是頂端開口的幾10倍大,顯示該蟲應該從小就居住其中,並逐漸利用其附肢的刺激,造成珊瑚骨骼的過度增生,進而形成蟲癭〔6〕,臺灣也有發現這種蟲癭的紀錄。鄭有容(本文筆者之一)也從癭葉表孔珊瑚(Montipora
aequituberculata)群體上的蟲癭內,發現了琉球異錨珊虱(Allopodion ryukyuensis)和表孔異錨珊虱
(Haplomolgus montiporae)(圖二)等的存在〔7〕。
珊瑚與橈足類間的化學擬態物質和化學訊息溝通假說
雖然都是寄生在珊瑚身上,但珊瑚寄生橈足類在外表、飲食習慣和表現上都有不同特徵,以和宿主建立密切的聯繫,例如,劍水蚤目的珊虱為寄生在珊瑚蟲消化腔內的體內寄生蟲,牠們會攝食珊瑚的共生藻類(共生藻;Symbiodinium),並將這些藻類暫時性地保留在體內,藉由行光合作用產生能量 〔8〕;吸管口目為珊瑚體外寄生蟲,牠們可以通過長管狀的口器(siphon tube),吸食珊瑚黏液;外寄生性的劍水蚤利用刮刀狀的下顎骨(mandible)刮食珊瑚黏液;暫棲性的猛水蚤則以微藻、細菌、顆粒有機物、其他動物組織及碎屑為食物來源。
外寄生性或暫棲性的珊瑚橈足類都偏愛居住在珊瑚群體表面,因此增加了被珊瑚刺細胞(cnidocyte)攻擊或殺死的機會。然而,根據共演化(Co-evolution)中的紅皇后假說(Red Queen Hypothesis,亦即物種與寄生生物都需要不斷演化才能生存),這些珊瑚寄生橈足類也可能在長時間的演化過程中,獲得一些能力或機制來克服這種情況。筆者之一鄭有容與戴昌鳳在研究寄生橈足類重新感染珊瑚的過程,提出了珊瑚─橈足類間的化學擬態物質/化學訊息溝通假說。他們發現:(1)寄生橈足類體表可能具有某些未知的化學物質,使珊瑚無法辨視牠們,因而避免珊瑚的刺絲胞毒性;(2)珊瑚和寄生橈足類間似乎存在溝通的方式,當寄生橈足類碰觸到觸手(tentacle)緊縮的珊瑚蟲後,這些珊瑚蟲會緩慢地舒展,並允許這些內寄生性的橈足類進入牠們的腸腔(圖三)〔9〕。
圖三:珊瑚寄生橈足類重新感染珊瑚的過程。由左至右分別為:橈足類尋找珊瑚蟲;珊瑚蟲與橈足類接觸後,觸手開始伸展;橈足類被允許進入珊瑚蟲腸腔。箭頭表示橈足類的頭部。仿自〔9〕。
三相共生(橈足類─共生藻─珊瑚的關係)
前文提到有些珊瑚寄生橈足類可能會在牠們的腸道中,暫時保留共生藻細胞以進行光合作用,透過實驗發現,這種光共生關係可能有利於牠們的生存。
筆者之一鄭有容與戴昌鳳也在珊虱的腸道中發現了大量的單細胞藻類,這些藻類表現出共生藻的典型特徵(馬蹄形的澱粉核),然而,退化的共生藻細胞與葉綠體的部份分解(圖四)仍顯示這些橈足類可能在某種程度上還是會消化珊瑚的共生藻。有趣的是,橈足類可能會在腸道中保留完整的共生藻細胞,即使只以滅菌海水飼養珊瑚寄生橈足類,飼養過程中僅提供換水維持固定海水鹽度,不再添加任何可能的食物或營養來源,經過兩週的實驗之後,這些空腹且飢餓的橈足類的腸道及糞便中之共生藻仍保持活力和光合活性(圖四)。因此,共生藻和珊瑚橈足類之間可能也存在暫時保留(temporary retention)或不穩定共生(unstable symbiosis)的機制,相反地,共生藻則似乎具有藉由橈足類的排泄物散播的可能性。
另外,為了探究共生藻和橈足類的共生行為是否也對橈足類有所助益,研究人員隨即以控制光照與添加光合作用抑制劑(DCMU)等不同環境下的對照組進行培養實驗,以測試腸道中的共生藻是否有助於橈足類的生存。研究發現,完全黑暗組別及添加 DCMU組別的橈足類,在五天的飼養過程中,死亡率高達100%,死亡率在統計上明顯高於有光照及無添加DCMU組。這個結果表示,共生藻行光合作用的產物可能有利於橈足類的生存。
珊瑚共生藻藉由光合作用將無機碳轉變為有機碳,並提供珊瑚高達 95% 的能量,這種共生關係對珊瑚礁的初級生產力起著關鍵作用,也因此,才能讓原本屬於寡營養鹽水質的珊瑚礁生態系擁有如此高的基礎生產力及生物多樣性;共生藻的存在對於橈足類的存活也具有明顯助益。共生(symbiosis)是生物界中特殊的行為模式,三相共生(橈足類─共生藻─珊瑚)更是罕見,這可能有助於珊瑚礁的高物種多樣性和初級生產力。
珊瑚白化之生物指標
寄生橈足類與其他寄生蟲一樣,牠們的感染能力受到宿主的生理狀況以及非生物環境因子影響。同樣地,珊瑚寄生橈足類的感染也可能受到珊瑚宿主的健康狀況影響,或是說受到珊瑚共生藻密度影響,因為珊瑚生長所需的能量有80至95%皆由共生藻提供,可以說珊瑚的健康狀況與共生藻密度息息相關。
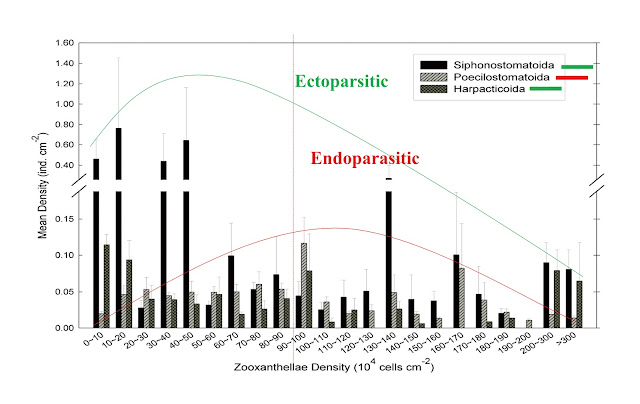
鄭有容也研究了臺灣墾丁海域細枝鹿角珊瑚上的寄生橈足類與珊瑚白化/共生藻密度間的關係〔2〕。他們的研究結果顯示,內寄生、外寄生、暫棲型等類型的橈足類其感染密度(mean
density)與珊瑚共生藻密度(zooxanthellae density)有明顯不同。健康珊瑚具有較高抵抗橈足類感染的能力;已白化的珊瑚若又不幸被外寄生性橈足類感染,其病情將會更為嚴重;而內寄生性橈足類則會在共生藻密度不足時離開宿主(圖五)。珊瑚在夏季時最容易被寄生橈足類感染,可能與珊瑚長時間暴露於高水溫中,健康狀況低下,導致免疫防禦機制減弱有關。另外,研究也顯示,珊瑚寄生橈足類感染之能力、種類及數量的變動也與牠們的食物選擇(如珊瑚黏液、有機碎屑、共生藻等)和行為(外寄生、內寄生或底棲等)以及宿主珊瑚群體的表面積有關,亦與周圍海水中硝酸鹽和葉綠素a(Chlorophyll a)的濃度相關。因此,可以進一步探討應用珊瑚寄生橈足類作為生物指標,預測珊瑚健康狀況的潛力。
寄生橈足類的散佈及其對珊瑚幼蟲可能的影響
目前已知珊瑚寄生橈足類可以寄生在珊瑚的早期發育階段,例如因環境壓力從珊瑚群中分離出來的逃脫珊瑚蟲(bail-out polyps)和初級珊瑚蟲(primary
polyps)(圖六)。內寄生性的珊虱會躲在珊瑚蟲的體內,被感染的珊瑚蟲因躲藏在內的橈足類而出現隆起及腫脹,直接或間接地影響珊瑚蟲的發育、著床(settled)、變態和骨骼形成,更特別的是,牠們在環境突然改變的情況下,為了逃離目前的環境,牠們會直接撕裂珊瑚蟲,造成珊瑚蟲的死亡。逃脫珊瑚蟲原本即為珊瑚在不適環境下的逃生機制,但是寄生橈足類可以寄生在這些珊瑚蟲之內,甚至造成牠們的死亡,當然也直接降低了珊瑚適應環境的能力。
珊瑚寄生橈足類的生活史及散佈方式仍不清楚,不過珊瑚蟲在寄生橈足類遠距離傳播方面可能發揮了極為重要的功能。珊瑚實囊幼蟲(planulae)和逃脫珊瑚蟲通常會在二至九天內定居和變態〔11〕〔12〕,但在某些情況下,實囊幼蟲並不會著床,維持浮游狀態長達六個月之久〔13〕。如果是這樣,除了寄生橈足類典型傳播策略(無節幼蟲和橈足類幼蟲)之外,逃脫珊瑚蟲極為可能是這些行動緩慢的珊瑚寄生橈足類能廣泛在三大洋傳播的潛在途徑。
參考文獻
1. Humes A G (1985) Cnidarians and copepods: a success story.
Transactions of the American Microscopical Society 104:313–320.
2. Cheng Y R, Anderson B M,
Meng P J, Dai C F, and Huys R (2016) Copepods associated with scleractinian corals: a worldwide
checklist and a case study of their impact on the reef-building coral
Pocillopora damicornis (Linnaeus, 1758) (Pocilloporidae). Zootaxa
4174:291–345.
3. Walter T C and Boxshall
G (2023) World of Copepods database. http://
www.marinespecies.org/ copepoda.
4. Stock J H (1988) Copepods associated with reef corals: a
comparison between the Atlantic and the Pacific. Hydrobiologia 167:545–547.
5. Humes A G (1985) A review of the Xarifiidae (Copepoda, Poecilostomatoida), parasites of
scleractinian corals in the Indo- Pacific. Bulletin of Marine Science 36:467–632.
6. Dojiri M (1988) Isomolgus desmotes, new genus, new
species (Lichomolgidae), a gallicolous Poecilostome copepod from the scleractinian coral
Seriatopora hystrix Dana in Indonesia, with a review of gall inhabiting
crustaceans of anthozoans. Journal of Crustacean Biology 8:99–109.
7. Cheng Y R, Dai C F, and
Chang W B (2010) Two species of
gall-inducing poecilostomatoid copepods on the scleractinian coral, Montipora
8. Cheng Y R and Dai C F (2010) Endosymbiotic copepods may feed on
zooxanthellae from their coral host, Pocillopora damicronis. Coral Reefs 29:13–18.
9. Cheng Y R and Dai C F (2009) The infection process of a parasitic
copepod, Xarifia obesa, with Stylophora pistillata. Coral Reefs 28:681.
10. Chan B K K, Wong J H, and
Cheng Y R (2019) Biogeography and
host usage of coral-associated crustaceans: barnacles, copepods, and gall crabs
as model organisms. Evolution and Biogeography 8:183–215.
11. Sammarco P W (1982) Polyp bail-out: an escape response to
environmental stress and a new means of reproduction in corals. Marine Ecology
Progress Series 10:57–65.
12. Glynn P W, Colley S B,
Mate J L, Cortes J, Guzman H M, Bailey R L, Feingold J S, and Enochs I C (2008) Reproductive ecology of the
azooxanthellate coral Tubastraea coccinea in the Equatorial Eastern Pacific:
Part V. Dentrophylliidae. Marine Biology 153:529–544.
13. Mizrahi D, Navarrete S A,
and Flores A A V (2014) Groups travel
further: pelagic metamorphosis and polyp clustering allow higher dispersal
potential in sun coral propagules. Coral Reefs 33:443–448.






沒有留言:
張貼留言